
Круговорот углерода, СО2 и время
В предыдущем выпуске ТрВ-Наука Борис Штерн и Игорь Эзау уже дали важные объяснения парниковому эффекту1.
И мы уже знаем, что СО2 играет чрезвычайно важную роль в регулировании температуры поверхности планеты. Чтобы понять роль углекислого газа в формировании климата Земли, нам придется проделать небольшой экскурс в ее механизм.
Как мы помним, Земля уникальна в Солнечной системе: здесь есть вода и свободный кислород, и поэтому долгосрочный климатический термостат связан с геохимическими циклами в твердой земле, их взаимодействием с атмосферой, составом атмосферы и составом морской воды. Климат-контроль — это не только наблюдения за погодой, т. е. за процессами, протекающими в нашей тропосфере (др.-греч. τρόπος «поворот» и σφαῖρα «сфера»). Это контроль за круговоротом важнейших химических элементов, слагающих планету.
Каким образом углекислый газ выходит на такие важные позиции в нашем климате?
Попробуем понять, каким образом окисленный углерод стал таким важным соединением в нашем климате. Осадки из насыщенной водой атмосферы выпадают на поверхность земли, горные породы и почвы, происходят химические реакции, которые приводят к выветриванию и разложению химических веществ. Затем потоки воды переносят эти элементы в океаны. Железо (Fe) немедленно окисляется и осаждается. Алюминий (Al) содержится в нерастворимых глинистых минералах и считается относительно инертным. Остаются кальций (Ca) и кремний (Si) в качестве очень важных элементов. Они активно вовлечены в современные биогеохимические циклы и составляют оболочки различных организмов, которые формируются в океане и осаждение которых приводит к образованию кремнеземов (SiO2) и карбонатов (CaCO3). Где же здесь СО2? Чтобы понять это, нужно разобраться в круговороте углеродных соединений. Самая стабильная форма углерода на Земле — это окисленный С в виде СО2 и СаСО3. Такие соединения называются «неорганическим» карбоном, а фотосинтез использует солнечную энергию, производя «органический карбон». Проследить химические реакции превращения одних соединений углерода в другие — это, собственно, и означает расшифровать круговорот жизни [1].
Количество углерода в атмосфере исчезающе мало по сравнению с огромным количеством углерода на суше и в океане. Бо́льшая часть этого углерода содержится в виде карбонатов кальция в осадочных породах (называемых геологами известняками), и часть — как нерастворимые осадки органических отложений (называемых геологами керогеном) [2*]. Только небольшая часть, около шестидесяти атомов из каждого миллиона, в настоящее время находится в атмосфере почти исключительно в виде СО2. Для того, чтобы осесть на поверхности суши или в океане, СО2 должен либо в атмосфере вступить в соединение с водой, и тогда он выпадает вместе с дождем в виде угольной кислоты H2CO3, либо попасть в океан в растворенном виде. Как? Углерод циркулирует между атмосферой и твердой землей в результате разрушения и формирования пород земной коры. Как мы заметили выше, основными участниками в контексте климата являются Са и Si, и в качестве примера можно привести химическую реакцию расщепления Са-Si-компонента:
CaSiО3 + СО2 ⇔ CaCO3 + SiO2
Это каноническая реакция Ю́ри [3, 4] используемая для оценки глобального круговорота углерода в геосфере.
CaSiО3 — это минерал волластонит, с самой простой формулой из всех силикатных пород (без нерастворимых минералов), наиболее распространенных в земной коре (силикатные породы образуются в результате тектонических процессов, т. е. при огромном давлении и температуре, при остывании магмы и лавы). Его реакция с СО2 — это пример процесса химического выветривания. А правая часть реакции — карбонат кальция и кремнезём .
Реакция эта идет в обе стороны, т. е. если посмотреть на уравнение справа налево, то кальцит вступает в реакцию с кремнеземом тогда, когда донные осадки океанической плитой переносятся в зоны субдукции, т. е. погружения под другую плиту. Там высокие температуры и давление вызывают перекристаллизацию минералов в процессе метаморфизма. Это реакция называется метаморфической декарбонизацией. Снова образуется CaSiО3 и остается в мантии до поры до времени, а вот освободившийся углерод после окисления и превращения в СО2 стремится вырваться наружу. Это процесс «дегазации», и происходит он или во время извержения вулканов, или через горячие источники и гейзеры. СО2 снова оказывается в атмосфере и снова начинает участвовать в процессе выветривания.
Скорость выветривания зависит от наличия пресноводных осадков и стока, в которых могут растворяться горные породы. Скорость стока пресной воды зависит, в свою очередь, от климата Земли. Для того чтобы продемонстрировать роль воды в круговороте СО2, реакцию Юри можно представить в таком виде [5]:
CaSiO3 + 2СО2 + H2O → Ca2+ + 2HCO3– + SiO2 → CaCO3 + SiO2 + СО2 + H2O
Если в процессе выветривания силикатные породы разрушаются на суше, растворяясь водой, то реками и ручьями или грунтовыми водами они переносятся в океан. После того, как растворенный кальцит и кремнезём достигают океана, морские организмы используют их для формирования своих панцирей и раковин (или скелетов — в случае с кораллами). Их количество регулирует поглощение СО2 из атмосферы и суши.
Да, у Земли существует механизм самобалансирования углерода.
Потоки СО2 в результате выветривания и дегазации малы по сравнению с другими потоками, но если бы они были разбалансированы, например, если бы прекратилась дегазация, весь СО2 в атмосфере был бы израсходован на химическое выветривание за несколько сотен тысяч лет. Земля старше четырех миллиардов, так что, если проследить всю ее историю, можно сделать вывод, что потоки СО2 из продуктов выветривания, идущие в океан, и из дегазации, идущие в атмосферу, должны были быть сбалансированы. Земле удается сбалансировать эти потоки, находя правильную концентрацию СО2, это механизм стабилизации климата, называемый СО2-термостатом силикатного выветривания, или силикатно-карбонатным балансом. Иными словами, химическое выветривание силикатных пород контролирует климат, поглощая атмосферный углекислый газ.
В холодном климате общее количество осадков меньше, и, следовательно, уровень образования СО2, поглощаемого реакциями выветривания, более медленный. Следовательно, окисленный углерод стремится превратиться в CaCO3.
Дисбаланс в потоках позволит СО2, не использованному на выветривание, накапливаться в атмосфере, нагревать климат, увеличивать скорость выветривания и возвращать потоки дегазации и выветривания обратно к равновесию.
Если климат слишком теплый, окисленный углерод стремится остаться в атмосфере в виде СО2 и не балансируется кальцитом, осажденным в глубоководных отложениях. Но тогда СО2 потребляется на химическое выветривание быстрее, чем выделяется СО2 при дегазации Земли. Планета охлаждается, стремясь к балансу углеродного потока.
Суммируя сказанное выше простыми словами, можно сказать, что, если потеря углерода из мантии в результате вулканизма превышает возврат углерода в результате субдукции, разница добавляется к континентальной коре. При попадании вулканического углерода в океаны органические осадки создают карбонаты. Если вулканический углерод попадает в атмосферу, он попадет в континентальную кору по реакции Юри [6]. И, как мы видим, углеродный цикл регулирует и концентрацию воды в атмосфере. Запомним это для понимания парникового эффекта.
Какой бальзам для отрицателей! Получается, что независимо от того, мало или много СО2 в атмосфере, Земля найдет способ сбалансировать последствия?
Да, механизм саморегуляции существует. Но термостат регулирует СО2 и климат в геологической временной шкале в сотни тысяч лет.
На протяжении геологической истории тектонический термостат регулировал баланс углерода в атмосфере. Но не всегда справлялся! Случались на Земле такие процессы, за которыми термостат не успевал. Эпизоды таких поражений заканчивались глобальными вымираниями. Как известно, их было пять. Но после катастрофы механизм перестраивался и возвращал СО2 до концентрации, которая в создавшихся условиях обеспечивала жизнь. И эти концентрации очень сильно отличались друг от друга (рис. 1).
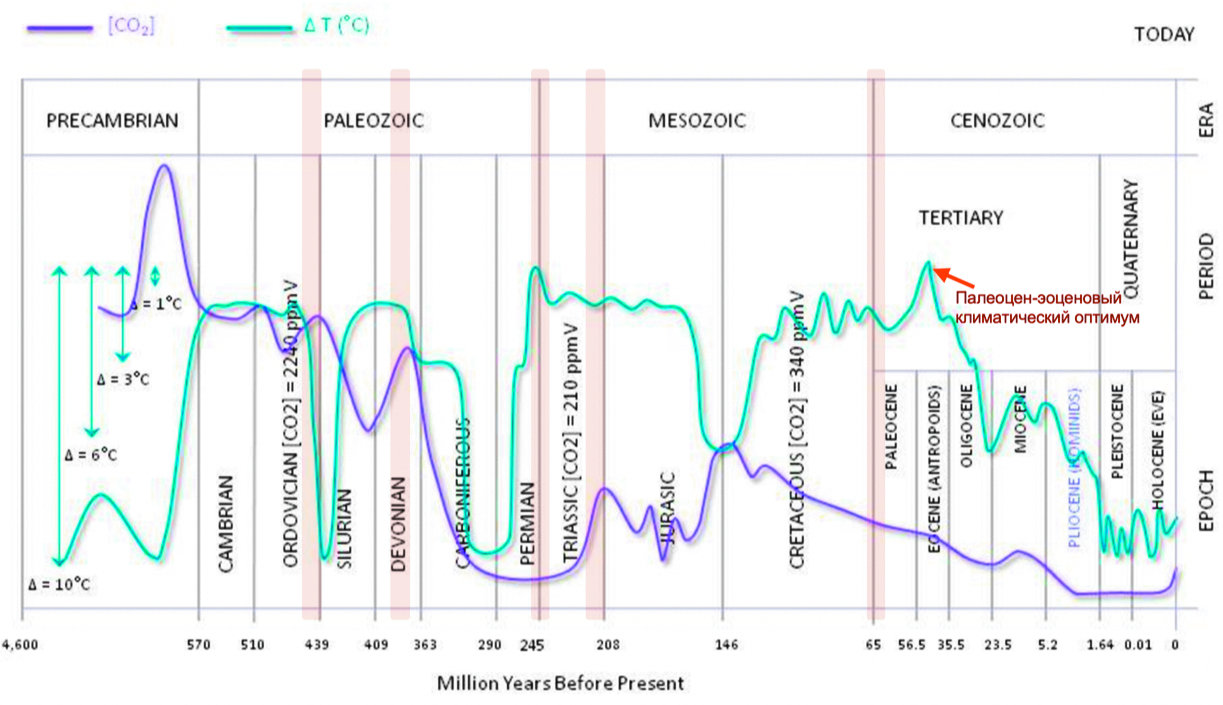
Итак, процессы балансирования СО2 идут очень медленно. И наблюдения на отрезке времени короче миллиона лет, процессы других масштабов вмешиваются в механизм саморегуляции. Новые исследования, анализирующие эффективность формулы Юри, количественно оценили параметры климатического оптимума палеоцен — эоцена (PETM: The Paleocene–Eocene Thermal Maximum). Это был период повышения глобальной температуры на 4–5 °C ~56 млн лет назад, связанный с импульсом вулканизма и дегазацией СО2 в северной части Атлантики. Было установлено, что для баланса СО2 в атмосфере после климатического оптимума потребовалось около 50 тыс. лет [5, 6]. За такое время много чего может произойти!
Как мы уже знаем [7], глобально климатом управляют циклы Миланковича, а в процессе смены ледниковий и межледниковий, а также их небольших подвижек — стадиалов и межстадиалов — происходит множество неожиданных отклонений, регулируемых динамикой атмосферы — океана, изменениями в функционировании термохалинной океанической циркуляции, изменением альбедо и многими другими важными факторами, которые мы еще не обсуждали.
Жить по 50 тыс. лет не могут даже самые лучшие из нас. Так что надежду на земную саморегуляцию происходящих сегодня процессов нужно пока оставить.
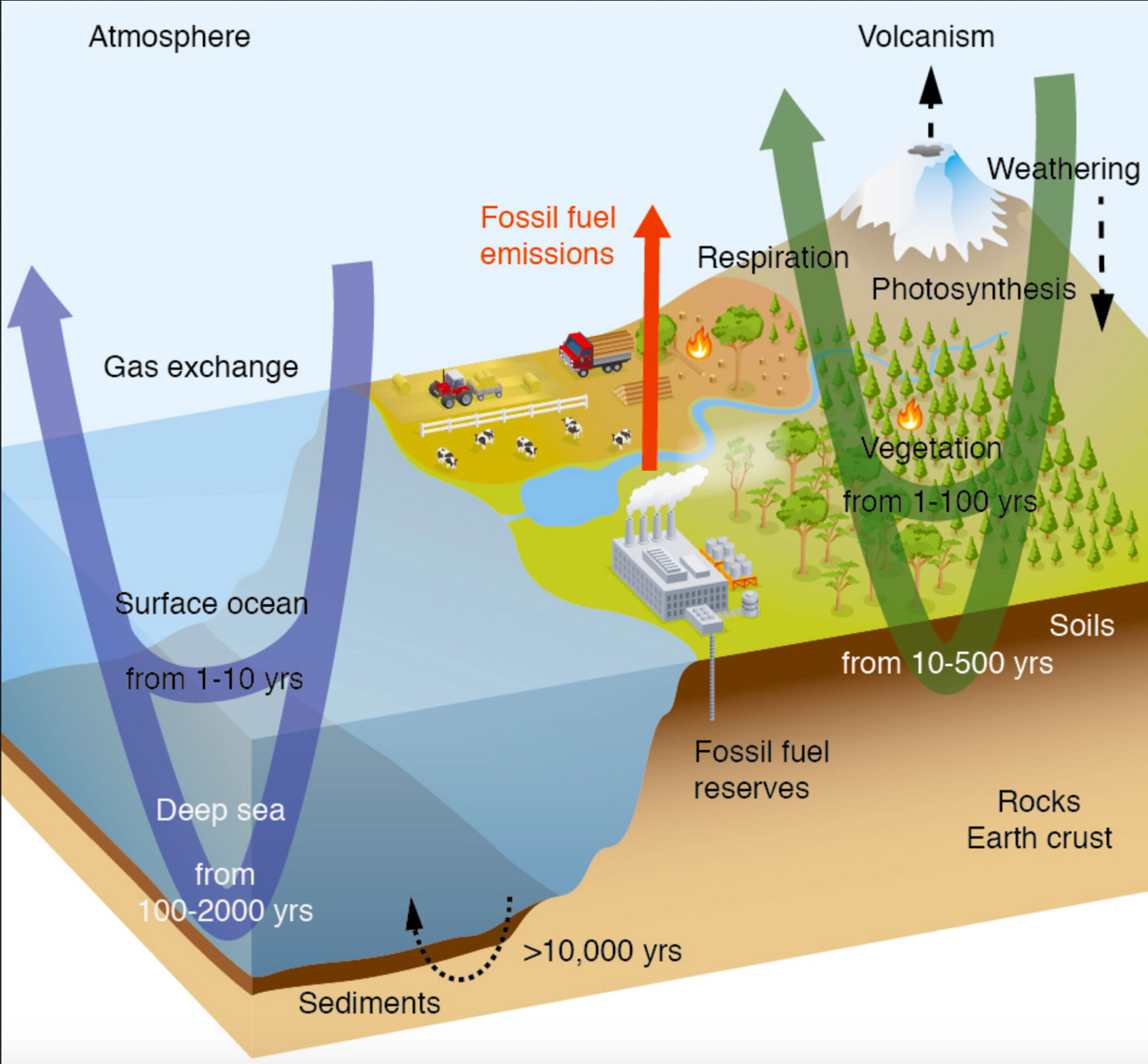
Источник: ipcc.ch/site/assets/uploads/2018/02/WG1AR5_Chapter06_FINAL.pdf
Понять термостат
Медленно дышащая Земля в настоящее время производит дегазацию в основном вулканами Ньираго́нго и Ньямурагира в Конго, Попокате́петлем в Мексике и Этной на Сицилии [8], и наблюдение за ними заставляет нас считать, что этот процесс протекает регулярно, хотя и сильно варьирует во времени, добавляя СО2 в атмосферу. Кроме того сейчас аккумулируется много CaCO3 на дне Атлантического океана, гораздо больше, чем уносится субдукцией, потому что активная субдукция происходит главными образом в Индийском и Тихом океанах. Это означает, что в прошлом скорость субдукции была гораздо выше, чем сегодня, потому что на долгом периоде осреднения колебания СаСО3 должны были быть сбалансированы. Балансируя еще свои старые процессы, погружая в зону субдукции больше СаСО3, Земля будет отдавать гораздо больше СО2 в будущем, чем отдает сейчас, согревая себя еще больше. И всё идет к тому, что силикатно-карбонатный термостат не сбалансирует текущих тенденций к перегреву планеты.
Мы подошли к важному выводу: зная механизм круговорота углерода, можно изменить установку термостата, создавая парниковый мир, подобный миру динозавров, или холодный мир, подобный сегодняшнему.
Отрицательный баланс углерода — это реакции выветривания, которые поглощают СО2. Горная местность выветривается быстрее, чем плоская равнина, покрытая плодородной почвой, потому что почва изолирует силикатные породы от дождевой воды, необходимой для выветривания. Гималаи — самая высокая горная система на Земле, возникшая в результате континентальной коллизии Индостана и Азиатской плиты несколько десятков миллионов лет назад, — продолжают подниматься. Существует гипотеза, что поднятие Гималаев может быть ответственным за нашу нынешнюю относительно прохладную эру, в отличие от «тепличных» периодов, таких, как меловой, или оптимума раннего эоцена (рис. 1), когда в воздухе могло быть в десять раз больше СО2, чем сегодня. Растения могут влиять на климат Земли, закачивая СО2 в воздушные поры в почве. Благодаря растениям, концентрации СО2 в почвенном воздухе могут быть в десять раз выше, чем в атмосфере. Дополнительный СО2 имеет тенденцию повышать скорость химического выветривания и потому что СО2 является компонентом реакции выветривания, и потому что СО2 оказывается кислотой, которая растворяет горные породы.
![Рис. 3. Распад избыточного количества СО2 в 5000 PgC (совпадает с гигатоннами углерода), выбрасываемого в «нулевой» момент времени в атмосферу, и его последующее перераспределение на суше и в океане в зависимости от времени, рассчитанное с помощью связанных климатических моделей углеродного цикла. Размеры цветных полос указывают на поглощение углерода соответствующим резервуаром: (1) атмосферное, океаническое поглощение и абсорбция сушей; (2) поглощение океаном; (3) реакция с карбонатами кальция в океане. Первые две панели показывают мультимодельное среднее из проекта взаимного сравнения моделей (Joos et al., 2013 [9]). Последняя панель показывает более долгосрочное перераспределение, включая растворение углеродистых отложений в океане, рассчитанное по модели промежуточной сложности системы Земли (Archer et al., 2009 [10]). Источник: ipcc.ch/report/ar5/wg1/carbon-and-other-biogeochemical-cycles/](https://trv-science.ru/uploads/297-0070.jpg)
Первые две панели показывают мультимодельное среднее из проекта взаимного сравнения моделей (Joos et al., 2013 [9]). Последняя панель показывает более долгосрочное перераспределение, включая растворение углеродистых отложений в океане, рассчитанное по модели промежуточной сложности системы Земли (Archer et al., 2009 [10]).
Источник: ipcc.ch/report/ar5/wg1/carbon-and-other-biogeochemical-cycles/
Растения появились на Земле около 400 млн лет назад, в силурийском периоде. Модели углеродного цикла предполагают, что это изменение в геохимии земной поверхности могло оказать огромное влияние на долгосрочный климат Земли. Если сравнить нас с другими планетами земной группы, то Венера, Земля и Марс все сначала имели атмосферу, но только Земля сохранила ее [11]. Венера оказалась слишком близко к Солнцу. Вода, которая очевидно присутствовала на Венере, испарилась в катастрофическом парниковом эффекте, в результате чего водород, перестав быть связанным с кислородом из-за диссоциации молекул воды в верхних слоях атмосферы жестким излучением Солнца, был потерян в космосе навсегда. Без воды реакции силикатного выветривания прекратились, что позволило углероду Венеры перейти в атмосферу. Термостат оказался сломан. В результате весь углерод Венеры попал в атмосферу в виде СО2.
Марс — маленькая планета, его диаметр в два раза меньше земного, поэтому он охлаждается быстрее, чем Земля. Источником углерода на Марсе, как и на Земле, была вулканическая дегазация, но сегодня Марс геологически мертв, на нем нет тектоники плит. Поэтому единственным источником углерода остается испарение с поверхности СО2-льда. Если учитывать весь СО2-лёд, то парциальное давление СО2 (pСО2) на поверхности Марса выше, чем на Земле, но углекислого газа совершенно недостаточно в воздухе, чтобы привести планету к точке таянья льда, что включило бы химические реакции выветривания. Если бы на Марсе происходила дегазация СО2 и если бы была вода, вероятно, в конечном итоге концентрация СО2 возросла бы до необходимого уровня. Но дегазации нет, поэтому термостат СО2 на Марсе тоже сломан, но не так, как на Венере [11].
Термостаты Венеры и Марса сломаны [12].
Как видите, термостат планет Солнечной системы может быть сломан. Земле и нам вместе с ней повезло, у нас термостат работает, запущенный тектоническими процессами, он регулирует содержание углерода в разных ее резервуарах, поддерживая жизнь.
Очевидно, что мы не можем остановить тектонический термостат Земли, но можем его поломать.
Как? Разве наших малых сил может хватить на то, чтобы помешать такой махине?
Парниковый эффект и СО2
Согревающий эффект парниковых газов является фундаментальным фактом физики, а не вопросом «веры» или политического спора.
Ч. Лэнгмюр и В. Брокер [13]
Теперь, когда мы знаем, что СО2 был одним из основных компонент в ранних атмосферах планет земной группы [11], мы можем оценить его роль в современной атмосфере. Способность интенсивного поглощения энергии в инфракрасном спектре делает СО2 мощным регулятором парниковых газов и всего климата. Тот факт, что климат Земли оставался благоприятным для жизни по крайней мере последние 3,5 млрд лет несмотря на значительное увеличение солнечной светимости, как раз и объясняется более высокими концентрациями СО2 в атмосфере в прошлом, которые стабилизировали климат [5, 11].
В атмосфере Земли СО2 уступает только воде по своим свойствам парникового газа. Но как мы уже знаем, в атмосфере его предельно мало, особенно по сравнению с водой, которая считается парниковым газом номер один. Мы должны разобраться теперь, почему даже при незначительных концентрациях СО2 в нынешней атмосфере Земли он оказывается основным, да еще и антропогенным фактором изменения климата.
На рис. 4 вы видите химический состав атмосферы, парниковые газы перечислены в подписи к рисунку. Солнечная энергия, как всем хорошо известно, поступает на поверхность Земли в коротковолновом спектре. Если бы Земля была «черным телом», т. е. абсолютным поглотителем, вся солнечная энергия во всех спектральных областях была бы поглощена и реизлучена в атмосферу в инфракрасном спектре (ИК). В реальности Земля не является черным телом, у нее есть атмосфера и у нее есть альбедо. Только та энергия, которая пробивается к поверхности Земли через облака, аэрозоли (пыль в атмосфере) и не отражается с поверхности за счет высокого альбедо (например, в полярных областях, всё еще покрытых льдами), поглощается земной поверхностью. В атмосфере насчитывается семь основных парниковых газов, каждый из которых отвечает за определенный волновой диапазон в электромагнитном спектре [1, 6, 17]. Только в этом диапазоне конкретные газы выполняют свою работу: поглощают длинноволновое излучение, исходящее от земли, и затем реизлучают в том числе и обратно, в сторону земной поверхности. Понятно, что нужно не только знать концентрацию этих газов, но и учитывать их свойства для того, чтобы разобраться, какой из них влияет на перераспределение тепла в атмосфере в наибольшей мере.
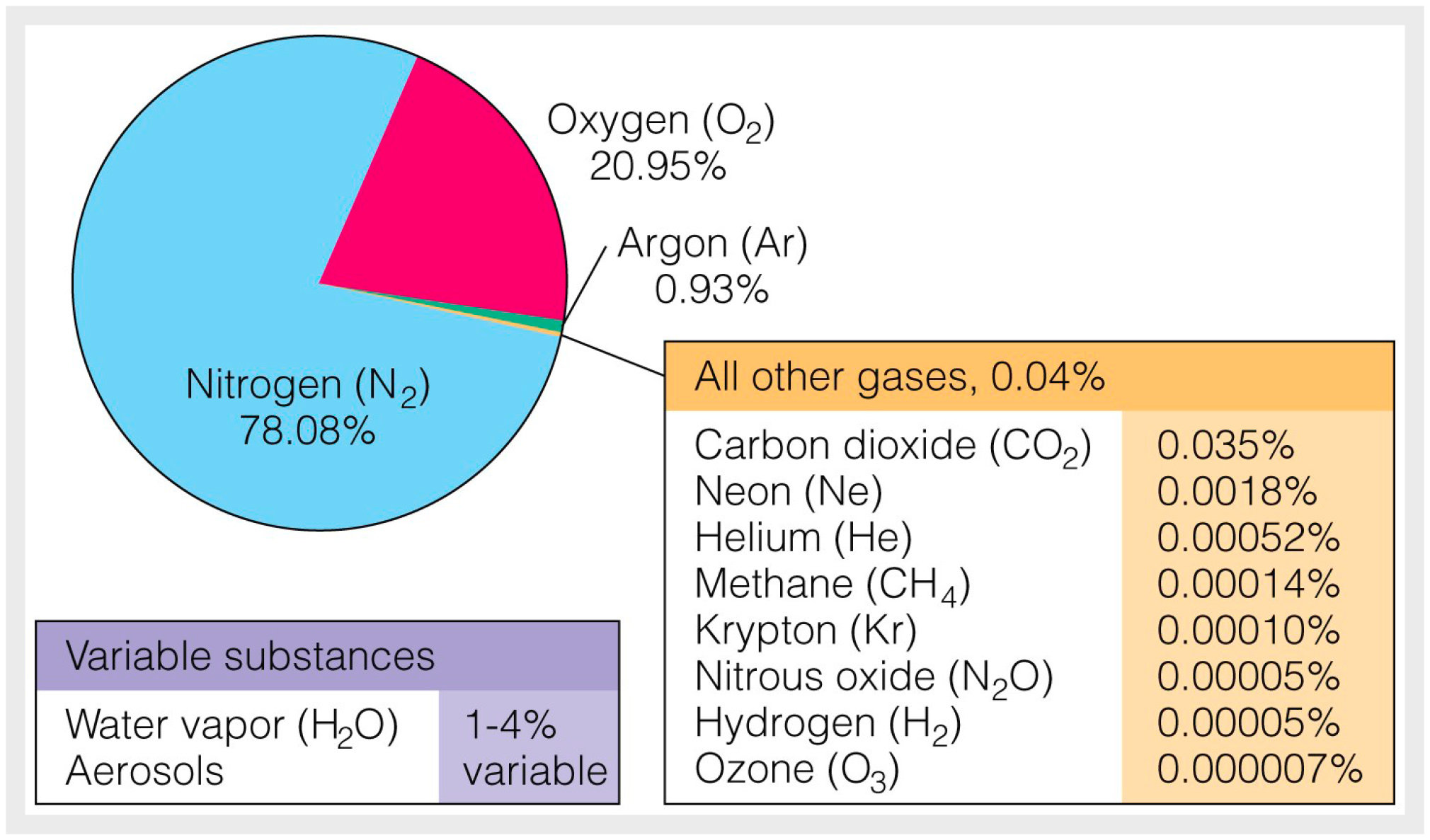
Разберемся немного в терминологии. Под концентрацией газа понимается количество молекул в определенном объеме воздуха. Проблема в том, что газы могут расширяться и сжиматься. То есть целесообразнее говорить о пропорциях этих газов, чем об их массе или количестве молекул. Например, на кислород приходится 20–21% всех молекул в составе атмосферы, а азот почти 80%. Доля СО2 на сегодняшний день ~0,0412%. Ту же величину можно выразить в частях на миллион (part per million, или ppm). Это число называется фактором смешивания (mixing ratio).
Общее давление смеси газов можно разделить на так называемые парциальные давления, присущие каждому типу молекул в газе. Парциальное давление СО2, например, записывается как рСО2. Оно пропорционально концентрации молекул данного газа вне зависимости от массы молекулы. Давление газа в единицах микроатмосфер (µatm) численно почти равно его фактору смешивания в частях на миллион (ppm). Суть в том, что парциальное давление газа более или менее пропорционально фактору смешивания, количественной пропорции газа. Если вы считаете в единицах давления атмосферы, фактические числа одинаковы для парциального давления и фактора смешивания. Например, для СО2 фактор смешивания в настоящее время составляет около 412 ppm, а его pСО2 — около 412 µatm.
Что происходит с углекислым газом после того, как он попадает в атмосферу?
Углекислый газ сначала быстро распределяется между атмосферой, верхними слоями океана и растительностью. В атмосфере он распределяется, управляемый конвекцией, согласно влажному адиабатическому падению температур с высотой (см. объяснения в прошлом номере [7]). В сущности, разница температур на поверхности Земли и в высоких слоях тропосферы и задают парниковый эффект.
Молекула воды в свою очередь взаимодействует с ИК-излучением в очень широком спектральном диапазоне. Поэтому вода является очень сильным парниковым газом [14].
Тогда что выдвигает СО2 на первую роль по сравнению с водой, если воды много и она очень мощный парниковый газ, а СО2 мало и он действует только в узком диапазоне?
Согласно известной нам формуле Юри, углерод продолжает перемещаться между различными резервуарами глобального углеродного цикла, такими как глубокий океан, горные породы и почвы. Некоторые из этих перемещений происходят очень медленно. В зависимости от количества выделяемого СО2, в атмосфере его будет оставаться от 15% до 40% на срок от 10 до 2000 лет [14], после чего устанавливается новый баланс между атмосферой, биосферой и океаном. СО2 долговечнее в атмосфере, чем все остальные газы. За время своего пребывания в атмосфере он согревает ее, усиливая парниковый эффект водяного пара, и суммарно поглощает и излучает больше ИК-радиации, чем все остальные газы вместе взятые.
Чтобы понять это последнее утверждение, нам нужно разобраться в графике на рис. 5.
![Рис. 5. Сплошная линия — это смоделированный спектр инфракрасного излучения, выходящего в космос в верхней части тропосферы. Для сравнения, пунктирные линии представляют собой спектры черного тела при разных температурах. Если бы на Земле не было атмосферы, исходящий спектр выглядел бы как спектр черного тела для 270 K, между показанными спектрами 260 K и 280 K. Атмосферное окно составляет около 850–1000 циклов/см, где газы не поглощают и не излучают инфракрасный свет. СО2, водяной пар, озон и метан поглощают инфракрасный свет, излучаемый землей, и излучают инфракрасный свет меньшей интенсивности на больших высотах, где воздух холоднее, чем на поверхности [12]](https://trv-science.ru/uploads/297-0063.jpg)
Как парниковый газ взаимодействует с земным излучением? Для ответа обратимся к Дэвиду Арчеру [12]: «На рисунке гладкие кривые показывают спектры черного тела для температур в диапазоне от 300 К, температуры поверхности в жаркий летний день, до 220 К, что является примерно самым низким значением температур на верхней границе тропосферы на высоте около 10 км. Ломаная линия показывает интенсивность излучения, которую инфракрасный спектрометр увидел бы, находясь на орбите над Землей и смотря вниз. Спектр излучения, покидающего Землю, уходящего в космос, колеблется между двумя различными спектрами черного тела: самым теплым около 270 К и самым холодным около 220 К. Части спектра, в особенности широкая, гладкая часть около 850–1000 циклов/см, соответствует теплому спектру черного тела. Так как не бывает газов в атмосфере, которые поглощают или излучают на этой частоте, значит, этот ИК-свет исходит непосредственно от Земли. Поскольку парниковые газы в атмосфере прозрачны для инфракрасного света в этой полосе частот, этот диапазон называется атмосферным окном» (см. рис. 5).
Температурные кривые черного тела подобны шкале температуры на термометре. По этой шкале можно определить температуру инфракрасного источника по его интенсивности.
Вы видите на рис. 5 большой провал в спектре, вызванный СО2 около 700 циклов/см. ИК-излучение и его поглощение являются симметричными, поэтому СО2 поглощает интенсивный, «теплый» спектр ИК от Земли на этой частоте и повторно излучает ту же частоту, возникает диффузия фотонов, из-за которой во внешних слоях атмосферы фотонов меньше, соответственно температура и интенсивность излучения снаружи меньше. Атмосфера получается «оптически толстой» в диапазоне частот изгиба СО2 и «оптически тонкой» в атмосферном окне. График построен таким образом, что площадь под кривой спектра пропорциональна общему потоку энергии. Можно судить об изменении энергии в соответствии с изменением площади. Площади кривых абсолютно черного тела возрастают пропорционально температуре в четвертой степени по уравнению Стефана — Больцмана. Это работает также с «ломаным» спектром, представляющим общую потерю энергии планеты в космос. Эффект полосы поглощения состоит в том, чтобы уменьшить спектр черного тела поверхности Земли, уменьшая площадь и, следовательно, уменьшая поток восходящей энергии.
Метан поглощает инфракрасный свет в полосе около 1300 циклов/см. В то время как крупный «изгиб» СО2 поглощает прямо на пике спектра черного тела Земли, а метан поглощает один из хвостов спектра. В конкуренции между СО2 и метаном за право быть сильнейшим парниковым газом преимущество остается за СО2. Сейчас мы наконец поймем, почему.
Эффект «насыщения полосы»
На рис. 6 показаны результаты серии прогонов модели для различных концентраций СО2 в атмосфере в диапазоне от 0 до 1000 ppm. Атмосфера 2010 года содержала ~390 ppm СО2 [15]. Без СО2 атмосфера была бы прозрачной для света в диапазоне около 700 циклов/см, как в атмосферном окне. Добавление первых 10 ppm СО2 оказывает довольно заметное влияние на форму спектра исходящего света, происходит резкий V-образный врез вниз от спектра. Когда концентрация СО2 увеличивается до 100 и 1000 ppm, центр пика переходит в кривую черного тела к чуть более холодной температуре, чем 220 К, и не становится глубже, когда концентрация СО2 повышается до 1000 ppm. Это эффект насыщения полосы, где под полосой понимается диапазон частот, поглощенных СО2.
![Рис 6. Демонстрация насыщения полосы СО2. Добавление 10 ppm СО2 (вверху справа) имеет огромное значение для спектра уходящего инфракрасного света относительно атмосферы, в которой нет СО2 (вверху слева). Увеличение СО2 до 100 и 1000 частей на миллион (нижние панели) продолжает влиять на спектр, но получается меньшая отдача от добавленного СО2, когда концентрация СО2 становится выше [12]](https://trv-science.ru/uploads/297-0062.jpg)
Однако энергетический баланс никогда не становится абсолютно нечувствительным к дальнейшим добавлениям СО2. Большее количество СО2 всегда сделает его теплее, даже при давлении в 70 атмосфер СО2 в атмосфере Венеры. Отчасти это происходит потому, что с увеличением концентрации СО2 полоса поглощения (см. рис. 6) становится шире, даже если она не может стать глубже. Середина полосы поглощения насыщена, но края ненасыщенные.
Центр полосы поглощения насыщается, но полоса продолжает становится шире при добавлении СО2.
Из всех парниковых газов только вода конденсируется и выпадает в осадки.
Таким образом, неконденсирующиеся парниковые газы, на которые приходится 25% общего земного парникового эффекта, обеспечивают стабильную температуру, которая поддерживает уровень атмосферного водяного пара и облаков через обратные связи, т. е. регулирует оставшиеся 75% парникового эффекта [15]. Без радиационного воздействия, в основном создаваемого СО2, земной парник разрушится.
Итак, мы пришли к выводу, что углекислый газ обладает необычайно широкими полномочиями в атмосфере, руководит круговоротом углерода на всей Земле и, самое главное, даже самое небольшое изменение его в атмосфере может привести к удивительным последствиям, не связанным с количеством тонн и молекул, которыми он представлен.
Насыщение полосы поглощения приводит к тому, что эффективная оптическая толща углекислого газа с увеличением его концентрации растет не линейно, а примерно логарифмически — так «работают» края полосы. Это значит, что величина парникового эффекта (то есть в конечном счете и наша температура воздуха) меняется одинаково с каждым удвоением СО2. Не имеет значения, сколько его было вначале, 10 или 100 гигатонн, радиационный эффект от удвоения 100 или 1000 ppm будет тот же.
Задуматься нужно над тем, что у нас очень мало СО2 в атмосфере сейчас. И удвоить его очень легко. Если бы мы переселились к динозаврам, то сделать это было бы практически невозможно. Вот тут и разгадка, почему в меловом периоде было так много СО2, «и ничего»! В этом смысле человечеству повезло, что оно пришло в мир с СО2 в 270 ppm, если бы оно было ниже, антропогенные температуры росли бы еще стремительнее.
Формулу подсчета увеличения температуры с ростом СО2 в атмосфере мы обсудим в следующий раз. И посмотрим, как всё это работало в голоцене.
Ирина Делюсина,
палеоклиматолог, факультет наук о Земле и планетах Калифорнийского университета в Дэвисе (США)
- Kasting J. F., Catling D. Evolution of a Habitable Planet. Annual Review of Astronomy and Astrophysics. 2003; 41(1): 429–63.
- (*) В данном случае мы не рассматриваем углерод, запертый в земной мантии и ядре: однако нужно помнить, что поверхностные резервуары содержат только небольшую долю углерода на Земле. Основными резервуарами углерода в настоящее время являются, по убывающей, ядро, мантия и континентальная кора. По существующим оценкам, масса углерода в ядре составляет 4 × 109 гигатонн (3), в мантии — 2×108 гигатонн (3), в коре — 4,2×107 гигатонн (6).
- Urey H. C. On the Early Chemical History of the Earth and the Origin of Life. Proc. Natl. Acad. Sci. USA. 1952; 38(4):351–63.
- Роль этой реакции в поддержании низкой концентрации СО2 в атмосфере Земли, была сформулирована Юри (1952). «С тех пор, как сформировался углекислый газ, он реагирует с силикатами с образованием известняка. Конечно, силикаты могли иметь различный минералогический состав, но давление СО2 всегда поддерживалось на низком уровне благодаря этой реакции или подобным реакциям, точно так же, как сейчас».
- Kellogg L. H., Turcotte D. L., Lokavarapu H. On the Role of the Urey Reaction in Extracting Carbon From the Earth’s Atmosphere and Adding It to the Continental Crust. Frontiers in Astronomy and Space Sciences. 2019; 6(62).
- Wedepohl Hans K. The composition of the continental crust. Geochimica et Cosmochimica Acta. 1995; 59(7):1217–32.
- trv-science.ru/2020/01/28/lyod-СО2-i-vremya/
- Aiuppa A., Fischer T. P., Plank T., Bani P. СО2 flux emissions from the Earth’s most actively degassing volcanoes, 2005–2015. Scientific Reports. 2019; 9(1): 5442.
- Joos F., et al., 2013: Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis. Atmos. Chem. Phys., 13, 2793–2825.
- Archer D., et al., 2009: Atmospheric lifetime of fossil fuel carbon dioxide. Annu. Rev. Earth Planet. Sci., 37, 117–134.
- Hunten D. M. Atmospheric evolution of the terrestrial planets. Science. 1993; 259(5097): 915–20.
- Archer D. Global Warming. Understanding the Forecast. Wiley, 2012.
- Langmuir Ch., Broecker W. How to Build a Habitable Planet, Princeton University Press. 718 p, 2012.
- IPCC Report
- Lacis A. A., Schmidt G. A., Rind D., Ruedy R. A. Atmospheric CO2: Principal Control Knob Governing Earth’s Temperature. Science. 2010; 330(6002): 356–9.
- Toth R. A., Brown L. R., Miller C. E., Malathy Devi V., Benner D. C. Spectroscopic database of CO2 line parameters: 4300–7000 cm–1. Journal of Quantitative Spectroscopy and Radiative Transfer. 2008; 109(6): 906–21.
- Greenhouse Gases. NOAA Climate Monitoring.
1 trv-science.ru/2020/01/28/globalnoe-poteplenie/


 (10 оценок, среднее: 3,40 из 5)
(10 оценок, среднее: 3,40 из 5)
Ирина, в представленной реакции Юри тройка у иона бикарбоната стоит не на месте. В том виде, в котором вы представили реакцию Юри, образоваться карбонат кальция не может, т.к. он образуется при условии, когда произведение концентраций ионов кальция и карбонат-ионов превышает произведение растворимости карбоната кальция (кальцита). Иными словами, вместо бикарбоната должен фигурировать карбонат-ион. Это стандартная ошибка у тех, кто не имеет профильного образования по химии. Слева напишите значение первой константы диссоциации угольной кислоты, а под ней значение произведения растворимости кальцита. Справа значение второй константы диссоциации угольной кислоты и сопоставьте значение второй константы диссоциации со значением первой и со значением произведения растворимости. В первом случае вторая константа диссоциации будет существенно меньше первой, а во втором будет отличаться всего на несколько порядков. По этой причине при образовании малорастворимых соединений в воде второй константой диссоциации пренебрегать нельзя, т.к. вы тогда выбрасываете из рассмотрения сам процесс образования малорастворимых соединений в воде. Так поступили физиологи при описании кислотно-щелочного баланса в организме человека и выбросили из рассмотрения процесс образования в организме человека такого патогенного биоминерала, как кальцит. Процесс образования карбоната управляемый. При фиксированной концентрации карбонат-иона, благодаря произведению концентраций ионов кальция и карбонат-иона, пересыщение может быть достигнуто за счет увеличения концентрации ионов кальция в растворе. При фиксированной концентрации ионов кальция, исходя из материального баланса для карбонат-иона С = [H2A] + [HA-] + [A2-], где: С – исходная полная концентрация угольной кислоты, А – СО3, пересыщение может быть достигнуто за счет увеличения исходной полной концентрации угольной кислоты, а при фиксированной этой концентрации, за счет изменения кислотности среды. Приведенные выше условия позволяют управлять зарождением и ростом кристаллов в гелях. Далее я буду использовать результаты, которые мы получили при исследовании зарождения и роста кристаллов в гелях. Эксперименты показали, что пересыщение является только необходимым условием для зарождения кристаллов в гелях. Кристаллы зарождаются и растут в дисперсионной среде, т.е. в растворе, поры… Подробнее »
Уважаемый Л.Л. Гошка,
Вы потратили много времени на свой комментарий, так что я сочла правильным ответить по существу. Иначе читатель запутается и получит искаженное представление о сути дела. Мне пришлось проконсультироваться с профессором-химиком, моим Университетским коллегой, и химическую часть моего ответа он досконально проверил.
Ваш комментарий кажется мне странным и немного противоречивыми. Утверждение, что «карбонат кальция не может образоваться» не имеет смысла, именно потому, что превышение его произведения растворимости означает, что он выпадет в осадок. Именно так происходит химическое выветривание в природе с участием воды.
В любом случае, вторая формула в тексте, со ссылкой на статью Kellogg et al, 2019 дает дополнительную информацию об уравнении, которое учитывает как присутствие воды, так и карбоната кальция.
Кроме того, еще один отвлекающий маневр в вашем комментарии, уводящий внимание в сторону от сути вопроса, – это фактическая диссоциация углекислоты. Стандартные литературные значения ее константы диссоциации в данном случае некорректны, потому что они игнорируют равновесие между газообразным и жидким СО2. А при изучении геологических процессов, очень важно учитывать фазовое состояние вещества.
Проще говоря, внешнее давление СО2 будет влиять на измеренные значения кислотной диссоциации СО2 простым применением принципа Ле-Шателье. Это действительно намного более сильная кислота, чем при обычно цитируемых значениях Ka, но выпадение CO2 из раствора подавляет его диссоциацию.
В этом легко запутаться. Но так как в природе этот процесс осуществляется и продукт можно «пощупать руками», и в данном случае ваше замечание к делу отношения не имеет.
Для комментариев на последний абзац, вам нужно найти химика твердого тела, но к существу дела это вообще не имеет никакого отношения.
Как вы справедливо заметили, я не химик, и больше мне точно нечего добавить по существу вопроса. Так что пожалуйста, напишите какую-нибудь теоретическую заметку по кристаллохимии, чтобы труд Щукина и др., и ваш, не пропадал. Там и продолжите дискуссию. С уважением, – Ирина Д.
При растворении СО2 в воде образуется угольная кислота, которая при диссоциации образует бикарбонат, при диссоциации бикарбоната образуется карбонат-ион, который взаимодействуя с ионами кальция, образует малорастворимое в воде соединение карбонат кальция в виде осадка. Таким образом, если учесть диссоциацию воды, имеем пять констант и, как минимум, систему из пяти уравнений. Одна константа растворимости СО2, две константы диссоциации угольной кислоты, произведение растворимости карбоната кальция и константа диссоциации воды. Как сместить равновесие и получить пересыщение, я уже описал. Данный процесс без всякого выветривания хорошо моделируется при выращивании кристаллов в гелях. Прочитаете монографию Г.Гениша «Выращивание кристаллов в гелях» узнаете много чего интересного. После этого ничего «щупать руками» не надо, а можно управлять процессом зарождения и ростом кристаллов в различных дисперсных системах. Г.Гениш данный процесс описывает следующим образом: В гелях на основе метасиликата натрия кальцит образуется путем взаимодействия карбонатов с солями кальция. Для выращивания кристаллов по этой реакции предложено два метода. В первом из них для I – образной пробирки гель сам по себе содержит карбонат. После того как гель застывает, раствор кальциевой соли наливают поверх геля и дают возможность ей продифундировать в гель. Попытки смешивать соль кальция с гелем оказались безуспешными, поскольку при значениях рН больше 7 образуется осадок силиката кальция. При более низких значениях рН этого осаждения удается избежать, но возникает опасность образования СО2, который может разрушить гель. Во втором методе нейтральный гель первоначально не содержит ионов кальция и карбоната . Эти реагенты диффундируют в гель с двух сторон и при взаимодействии образуют кальцит. Такой процесс удобно проводить в U – образных пробирках или сосудах. Эти два метода позволяют за 6 – 8 недель вырастить хорошо ограненные ромбоэдры кальцита размерами до 5 мм. Таким образом, Г.Гениш не только описал механизм, который является составной частью утилизации отходов метаболизма экосистем в косном веществе, но и обобщил этот механизм. Он подчеркивает, что используя различные кислоты… Подробнее »
Начнем с того, что вообще не бывает такого иона «HCO–3». Бывает ион «HCO3–» (бикарбонат-ион). При этом 3 должно быть нижним индексом, а минус — верхним.
Это поначалу казалось просто случайной опечаткой в Вашей статье, очевидной любому химику. Но, я смотрю, Вы ее защищаете? Когда Л.Л.Гошка обратил на нее Ваше внимание: «Ирина, в представленной реакции Юри тройка у иона бикарбоната стоит не на месте», Вы дали поразительный ответ: «Мне пришлось проконсультироваться с профессором-химиком, моим Университетским коллегой, и химическую часть моего ответа он досконально проверил.» «больше мне точно нечего добавить по существу вопроса».
Что это был за «профессор-химик»?
Я тоже решил, что это опечатка, но если Irina D права, то в России «профессор минус химик» не сдал бы вступительный экзамен на химфак университета. Я заглянул в статью Kellogg L.H. et al [5], — там реакция Юри (1) записана правильно, — индексы зарядов катиона кальция и аниона бикарбоната там, где они и должны быть.
https://www.frontiersin.org/articles/10.3389/fspas.2019.00062/full
или
https://pdfs.semanticscholar.org/70bf/df0796fc39a0b55f99fad335483afae5410e.pdf
Это опечатка, я прошу прощения, что я проглядела ее. Я проверила свои рукописи, она появилась на второй или третей копии, я не заметила. Сейчас исправим. А профессор-химик, в любом случае, не имеет никакого отношения к этой опечатке. Если вам интересно его имя, вот оно: https://chemistry.ucdavis.edu/people/neil-schore. И что собственно поразительного в том, что я проконсультировалась с настоящим химиком? Вы никогда не консультируетесь со специалистами по смежным дисциплинам? Вопрос риторический и ответа не требует.
Ирина, поразительно не то, что Вы проконсультировались. Поразительна степень «доскональности», как Вы выразились, проверки «химической части» статьи. При том, что на опечатку уже было прямо обращено внимание.
Человечеству повезло, что оно успело вовремя подогреть планету. Наступление очередного оледенения до начала промышленной революции могло отправить человеческую цивилизацию обратно в палеолит.
Да и биосфере с нами повезло — возвращение углерода в биогенный круговорот повышает накопление биомассы уже сегодня!
https://nplus1.ru/material/2019/04/19/greening-earth
Возврат к мягкому климату палеоцена-эоцена и избавление от ледниковий не может не радовать!
А вот попытки глобально «бороться» с этим однозначно благотворным в дальней перспективе явлением не могут не огорчать.
Что такое «циклы/см»? По-русски принято писать «обратные см» или см–1.
Это обсуждалось при подготовке статьи. Учитывая то, что на приведенной иллюстрации условное обозначение «wave number cycles/cm», я решила не менять его, чтобы не запутать читателей, особенно тех, кто не в курсе профессиональной терминологии. -Ирина Д.
На основе исследований П.А.Ребиндер выдвинул идею «созидание через разрушение». Суть идеи заключается в повышении прочности твердого тела путем его разрушения по всем дефектам снижающим реальную прочность, с последующим прочным сращиванием образовавшихся частиц. «…..При адсорбции ПВА происходит сольватация поверхности. Этот процесс сопровождается появлением микротрещин и разрушением тела под действием положительного расклинивающего давления». Е.С. Мухачева, Е. С. Оробейко, С. В. Егоров, Коллоидальная химия. Шпаргалка На мой взгляд, идея П.А.Ребиндера «созидание через разрушение» имеет глубокий физический смысл. По этому поводу Е.Д.Щукин рассказывает: «На фотографии, сделанной мною когда-то в Гаване, на Кубе видны трещины в мраморной плите, вырезанной всего сто лет тому назад. Прогиб и трещины развивались лишь под действием собственного веса плиты? Или чего-либо еще? Влаги?! Когда я показал этот снимок на лекции в компании «Амоко Ойл» в Чикаго, меня пригласили обсудить аналогичную ситуацию с их штаб-квартирой. Через 15 лет после завершения строительства 90% панелей покрытия из такого же каррарского мрамора оказались изогнутыми вовне, грозя растрескиванием и падением. На вопрос: Что было делать? – общепринятая вежливость удержала меня от ответа: 15 лет назад спросить нас, либо нашего американского коллегу Берта Вествуда. Тут надо было иметь в виду и кислотные дожди в Чикаго. Мрамор заменили потом «рукотворным материалом», потратив еще 20 млн долларов. Вот более крупные (и старые) трещины, возникшие под океанским соленым ветром в Рио-де-Жанейро. Но не нужно искать так далеко. То же самое вокруг нас, в разных стадиях разрушения. Такие повреждения бетонных скамеек в парке вызывают серьезные, тревожные размышления о долговечности и надежности пролетов мостов, балок перекрытий и др.» http://www.chem.msu.su/rus/vmgu/121/50.pdf Кроме этого Е.Д.Щукин говорит, что практически всегда разрушение тела или материала инициируется повреждением на поверхности, где оно зарождается локально при некотором критическом уровне упругих и/или остаточных деформаций, связанных с контактными (либо внутренними) напряжениями. Любой поверхности присущи два универсальных свойства: во-первых, избыток свободной энергии, т.е. ослабленность межатомных связей, и, во-вторых, доступность активным… Подробнее »
У меня нет никаких оснований, чтобы не доверять результатам исследований климатологов. Тем более они занимаются одной из самых важных проблем. По большому счету проблема не столько в потеплении или похолодании, а в том о чем писал В.И. Вернадский: 1. изучение явлений жизни в масштабе биосферы дает нам и более определенные указания на теснейшую связь между ней и биосферой. 2. явления жизни должны быть рассматриваемы как части механизма биосферы и что те функции, какие живое вещество исполняет в этом сложном, но вполне упорядоченном механизме – биосфере, основным глубочайшим образом отражаются на характере и строении существ. 3. среди этих явлений на первом месте должен быть поставлен газовый обмен организмов – их дыхание. 4. в мире организмов в биосфере идет жесточайшая борьба за существование – не только за пищу, но и за нужный газ. 5. эта борьба более основная, так как она нормирует размножение, т.е. дыханием определяется максимальная возможная геохимическая энергия жизни на гектар. 6. соглашаясь с выводами Ж. Дюма и Ж. Буссенго, и поэтому живое вещество может быть рассматриваемо как придаток атмосферы. 7. генетическая связь жизни с газами биосферы чрезвычайно велика. Газы биосферы всегда генетически связаны с живым веществом, и земная атмосфера им определяется в своем основном химическом составе. 8. возможно при жизни организма атомы углерода, уходящие в виде углекислоты в атмосферу или воду, происходят от стороннего в него входящего вещества – пищи, а не от вещества, строящего углеродистый остов организма. В.И. Вернадский делает важные выводы, что 1. в таком случае только в протоплазматической основе жизни и ее образованиях будут собираться удержанные в живой материи, не выходящие из нее атомы. 2. необходимо пересмотреть представление о характере обмена – движения атомов – внутри организма, об устойчивости протоплазмы, воззрения, выдвинутого еще К. Бернаром. 3. может быть, существует связь между этими идеями К. Бернара, между обобщениями К.М. Бэра относительно бережливости жизни и установленным геохимией… Подробнее »
Перспектива использования физико-химической механики при описании процесса утилизации отходов метаболизма экосистем огромна. Такие понятия, как «выветривание» и «коррозия» в строительстве не позволяют управлять процессом разрушения. Можно только предотвратить и замедлить этот процесс. Но, для зарождения и роста кристаллов в гелях, как и образование патогенных биоминералов в организме человека понятия «выветривание» и «коррозия» не приемлемы из-за невозможности управления данными процессами. Такое управление возможно с позиций физико-химической механики. Национальный доклад «Глобальный климат и почвенный покров России: оценка рисков и эколого-экономических последствий деградации земель. Адаптивные системы и технологии рационального природопользования (сельское и лесное хозяйство)» (под редакцией А.И.Бедрицкого) М.: Почвенный ин-т им. В.В. Докучаева, ГЕОС – 2018. 357 с. file:///C:/Users/GOSHKA/Downloads/NationalClimReport2018.pdf Цитата: В течение последних десятилетий в науке о климате особое внимание уделялось пониманию причин регистрируемых изменений климата и в оценках будущей эволюции климатической системы. К числу базовых вопросов, на которые можно дать относительно утвердительный ответ, относятся: • изменяется ли химический состав атмосферы; • теплеет ли вследствие этого климат; • ответственна ли за это хозяйственная деятельность человека? По всей видимости человечество ожидает усугубление наблюдаемых антропогенно обусловленных изменений климата (на фоне его естественных вариаций) и соответствующих климатических воздействий. Вместе с тем растет и понимание того, что из-за инерционности глобальной климатической системы даже самые радикальные меры по смягчению антропогенного воздействия на климат (в первую очередь, путем сокращения связанных с хозяйственной деятельностью выбросов парниковых газов), предпринятые сегодня, дадут ощутимый результат только спустя десятилетия, что означает возрастающее значение мер адаптации к происходящим и ожидаемым изменениям климата. Почвы формируют второй по величине после литосферы резервуар органического вещества планеты. Поэтому даже небольшое изменение почвенного резервуара органического вещества может оказывать значительное влияние на концентрацию двуокиси углерода (СО2) в атмосфере. 3.1. Почвы в углеродном цикле наземных экосистем России Углеродный цикл наземных экосистем представляет открытую биогеохимическую систему и находится в интенсивном углеродном обмене с атмосферой, литосферой и гидросферой. Суммарно, регулируемые почвами России биогеохимические… Подробнее »
Всё наглядно, вот только латынины этого читать не станут — им лениво…