

История нобелевских работ — это не только история открытий, но и история человеческих судеб, драма идей и калейдоскоп характеров. Недавнее присуждение Нобелевских премий по химии не стало исключением. 7 октября Нобелевский комитет назвал имена лауреатов премии по химии. Ими стали Эмманюэль Шарпантье (Emmanuelle Marie Charpentier) из Франции и Дженнифер Дудна (Jennifer Anne Doudna) из США. Официальная формулировка основания для присуждения премии: «за исследование метода редактирования генома». Неожиданным такое решения назвать никак нельзя, научная общественность, да и сами лауреаты ждали этого события еще год назад. Это легко просматривается в серии интервью, которые героини 2020 года уверенно давали еще в 2018–2019 годы, как будто уже осененные славой самой авторитетной научной награды. Особенностью премии 2020 года стал рекордно короткий временной интервал от первых публикаций лауреатов, посвященных системе редактирования генома, до собственно самого события. Многие сразу же заговорили о триумфе женской науки, но здесь не хотелось бы касаться гендерных вопросов, а просто повнимательнее всмотреться в личности героинь и предысторию исследований.
Сама Эмманюэль Шарпантье вспоминает, как в 12-летнем возрасте объявила маме, что будет работать в Институте Пастера. Ее научная биография начиналась в 1993 году с изучения антибиотикоустойчивости патогенных для человека микроорганизмов. Эта проблема стала одним из главных вызовов современной науки об инфекционных заболеваниях, и нет ничего удивительного, что юная микробиолог выбрала для себя именно это направление. Она упорно анализировала сотни штаммов клинических изолятов на предмет их устойчивости к тетрациклину, выделяла генетический материал, определяла вручную последовательности генов, ответственных за лекарственную устойчивость. Объем и характер этой работы может оценить любой, кто знаком с классической микробиологией и молекулярной биологией, — десятки тысяч пересеянных чашек Петри, многочасовое сиденье перед газовой горелкой.
Первая работа Эмманюэль вышла в 1993 году в журнале Gene и была посвящена характеристике генов резистентности к тетрациклину — добротное стандартное исследование, еще один штрих к общей картине генетической изменчивости и адаптации бактерий. После получения степени в 1995 году Эмманюэль осталась верна проблеме устойчивости к антибиотикам и продолжила работу в США. Она выбирала научные задачи, и оказалась в детском исследовательском госпитале в Мемфисе в отделе инфекционных болезней. И первый заметный успех — публикация в Nature в 1999 году о роли двухкомпонентной сигнальной системы стрептококков в определении устойчивости к резервному антибиотику ванкомицину, правда, в скромной роли одного из пяти соавторов. Затем последовал цикл работ по изучению отдельных компонентов транспортных и метаболических систем стафилококков, так или иначе причастных к патогенности и антибиотикорезистентности. И вдруг — неожиданный поворот в сторону роли малых некодирующих РНК в физиологии бактерий. Что это — научная интуиция или конъюнктура? Возможно, и то, и другое: интерес к этим молекулам возник в начале 2000-х, а впервые заговорили о них как о регуляторных еще в далеком 1967 году, о чем Эмманюэль не преминула упомянуть в своем обзоре, вышедшем в 2007 году. Это типичный в биологии пример возрождения на новом уровне интереса к старым и, казалось бы, за ненадобностью покрытым пылью «странным» результатам. Но пока интерес будущего Нобелевского лауреата оставался только теоретическим — последовал еще один обзор в 2010 году. И никакого намека на CRISPR-Cas!
И вдруг давняя любовь к системам патогенности бактерий, их способности к межвидовой миграции в бактериальных популяциях чудесным образом «сконъюгировала» с интересом к заманчивому миру малых РНК и их биогенезу. Это скрещение научных интересов «выстрелило» в виде статьи в Nature в 2011 году. В ней был по косточкам разобран один из механизмов нарезания тех самых направляющих РНК-гидов, которые вместе в ферментами-эндонуклеазами составляют «соль» системы генетического иммунитета CRISPR-Cas. Этот механизм предполагал участие казавшихся бесполезным балластом малых некодирующих РНК.
К моменту публикации Эмманюэль Шарпантье о системах CRISPR-Cas было уже многое известно. Сама аббревиатура CRISPR (clustered regularly interspaced short palindrome repeats, или сгруппированные периодические палиндромные короткие повторы, встречающиеся в геноме) была введена в оборот сотрудниками департамента инфекционных заболеваний факультета ветеринарии Утрехтского университета Барендом Янсеном с соавторами. Они же первыми обратили внимание на то, что вслед за повторами обязательно следуют гены ферментов, которые либо меняют структуру ДНК, подкручивая или раскручивая ее, либо способны точечно разрезать нуклеиновые кислоты. Ученых давно привлекали повторяющиеся фрагменты геномов, казалось бы, бессмысленные с точки зрения кодирования генетической информации о белках, но явно не случайно закрепленные в определенных позициях в ходе эволюции. Возможности для их изучения заметно росли по мере секвенирования новых геномов, в первую очередь бактериальных, в начале 2000-х.

Следующим знаковым событием на пути осознания функций описанных нидерландскими учеными последовательностей стали результаты двух групп из Франции и Испании, обнаруживших, что в составе CRISPRs встречаются кусочки геномов из эволюционно удаленных организмов — бактериальных вирусов, или бактериофагов. Это наблюдение заинтриговало исследователей: зачем бактериальный геном цепляет и сохраняет чужеродную ДНК? Результаты этого анализа были опубликованы почти одновременно в 2005 году. Примечательно, что тут впервые в истории изучения CRISPRs появляются фамилии ученых российского происхождения Александра Болотина и Алексея Сорокина, работавших тогда в Национальном институте сельскохозяйственных исследований Франции в лаборатории генетики микроорганизмов. Казалось бы, странный факт, не имевший на тот момент рационального объяснения, был замечен исследователями и доведен до сведения научной общественности. Похоже, это был переломный момент на траектории событий, связанных с нобелевским открытием. Постепенно понимание роли этих загадочных элементов бактериальных геномов стало обрастать фактами, извлекаемыми из сравнительного анализа генетических текстов и из экспериментов. И далее на всем этом пути наши соотечественники, работавшие в России и за рубежом, продолжали вносить немалый вклад в прогрессирующее развитие нового направления в первую очередь в виде новых оригинальных идей. В 2006 году в работе Киры Макаровой, Светланы Шабалиной, Николая Гришина, Юрия Вольфа и Евгения Кунина из Национальных институтов здоровья в США было впервые высказано предположение, что CRISPRs вместе с идущими с ними бок о бок в геноме генами ферментов составляют древнюю систему генетического иммунитета бактерий, призванную ограничить инфицирование бактериофагами. Выводы ученых базировались на серьезном анализе с использованием методов биоинформатики. Это была действительно красивая и, пожалуй, даже гениальная по точности предвидения работа но, увы, без наглядного экспериментального подтверждения. История повторяется (вспомним Нобелевскую премию за открытие теломеразы) совсем не как фарс, а как некая закономерность, когда именно ученые российских научных школ «на кончике пера» открывают новые механизмы, высказывают практически сложившуюся концепцию, которая потом подхватывается и получает подтверждение.

Так и случилось в 2007 году, когда группа исследователей из крупнейшей в пищевой индустрии США компании Danisco Inc. опубликовала статью, где первым в списке авторов шел Рудольф Баррангоу (Rodolphe Barrangou), в журнале Science. Коротенькая статья на трех страницах печатного текста повествовала о том, что наличие у Streptococcus thermophilus CRISPR-кассеты, содержащей фрагменты генома бактериофага, приводит к повышению устойчивости к фаговой инфекции. Разрозненные факты сложились в целостную картину. Такая публикация не могла пройти незамеченной, тем более, что ее предварял короткий редакторский комментарий, подчеркивающий общебиологическое значение этой работы. Обращает на себя внимание то обстоятельство, что исследование проведено не в каком-либо крупном университете, не в Национальных институтах здоровья США, а в RD-подразделении пищевой компании, занимающейся разработкой новых пробиотиков на основе молочнокислых бактерий. Работу сделали микробиологи, которые и по сей день продолжают выделять и пересеивать новые штаммы лактобацилл и бифидобактерий на благо оздоровления человечества. Стоит тут призадуматься о целесообразности развития научных групп на базе биотехнологических компаний. Ясное понимание насущных проблем производства и настоятельная необходимость искать их решение на основе достижений фундаментальной науки иногда становятся предпосылками для настоящих научных прорывов. Может быть, в том и кроется секрет необыкновенно высокой концентрации нобелевских лауреатов в «отдельно взятых станах», что не от фундаментальной науки требуют быстрого прикладного эффекта, а, наоборот, в высокотехнологичных компаниях дают право на жизнь маленькому островку фундаментальной по сути науки?
Дальше события развивались как снежный ком, пока что без участия нобелевских звезд 2020 года. И опять наши коллеги, теперь уже из Москвы, из Института биологии гена, Константин Северинов и его сотрудники внесли свою лепту, исследовав механизмы экспрессии генов системы CRISPR-Cas и опубликовав результаты в 2009–2010 годы. В этот период раннего развития исследований CRISPR-Cas фамилии российских ученых и выходцев из России составляют немногим менее трети в общем списке авторов публикаций. Как тут не задуматься о том, какой потенциал в области наук о жизни мы имели в начале 2000-х и, хотелось бы надеяться, не растеряли до сих пор?
Рудольф Баррангоу с удовольствием заимствовал метафору Евгения Кунина (затем последовали их многочисленные совместные публикации и весьма продуктивное сотрудничество) относительно роли CRISPR-Cas как иммунной системы бактерий, и началось победное шествие нового генетического механизма в мировой науке. Это действительно стало вехой в развитии геномики и всей современной биологии. Была реконструирована сеть взаимообусловленных событий в клетке, развивающихся во времени, требующих участия целого комплекса разных по своей природе биомолекул, и идентифицированы материальные носители и последовательность этих событий.
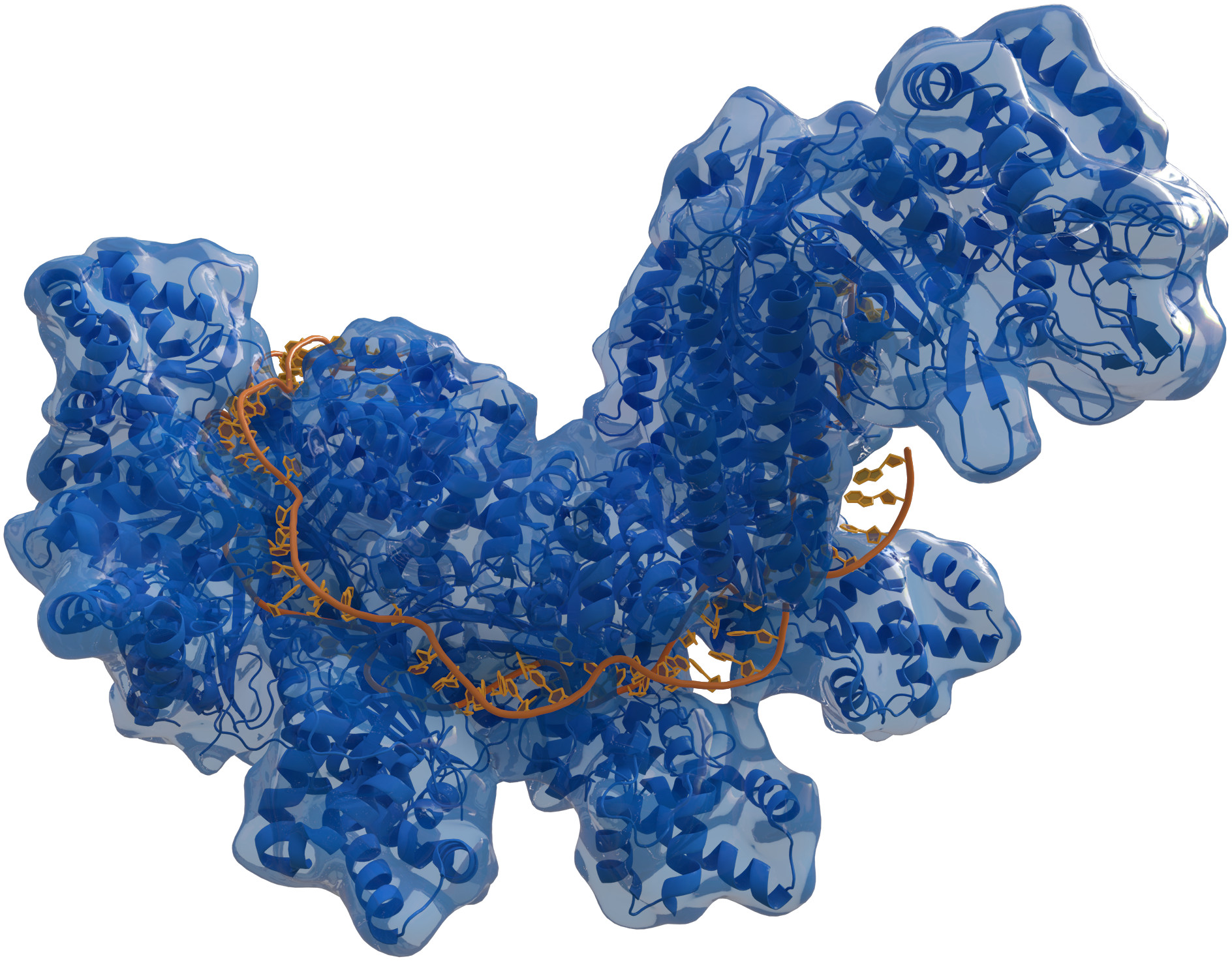
Но оставалась какая-то недосказанность. Вроде бы понятно, как в целом работает система, из каких компонентов она состоит. Но современная биология — это не только описание процессов, но и попытка заглянуть вглубь механизма самого явления на атомно-молекулярном уровне. Известно, что происходит разрезание чужеродной ДНК, что режущий инструмент (фермент ДНКаза), по всей вероятности, доставляется с помощью направляющих РНК-гидов. Но что при этом происходит внутри молекулярных комплексов, как их компоненты соприкасаются друг с другом и происходит собственно ферментативный акт? Это еще предстояло выяснить. Для этого требовались другие методы из области структурной биологии и химической энзимологии и другие люди.
Так в этот водоворот событий оказалась вовлечена профессор Калифорнийского университета в Беркли, химик-энзимолог Дженнифер Дудна. Ее коллега, специалист по геномике Джилиан Бенфилд из того же университета, работая со множеством нуклеотидных последовательностей бактерий и наблюдая разные комбинации компонентов CRISPR-Cas в геномах, была убеждена в необходимости их дальнейшего изучения на уровне межмолекулярных взаимодействий и структуры. Она посмотрела работы своих коллег поблизости и просто по-соседски позвонила Дженнифер с предложением заняться этими проблемами. Выбор был не случайным, к этому времени профессор Дудна считалась уже сложившимся специалистом по рибозимам и структурному анализу РНК, в том числе тех малых некодирующих РНК, составляющих один из винтиков в механизмах работы CRISPR-Cas. Здесь проявился феномен научных коммуникаций и взаимоотношений в научном сообществе, когда для того, чтобы выйти за рамки своих собственных возможностей в решении той или иной проблемы, нужно сделать шаг навстречу коллегам, поделиться идеей и дать начало новой работе. Возможен был и альтернативный вариант — «не выносить идею из избы», попытаться сделать эксперименты своими силами. Была выбрана коллаборация.
Надо сказать, что путь в науку у второго лауреата тоже начался с детских лет. Друг семьи, биолог, поручил школьнице во время летних каникул готовить окрашенные препараты микроскопических раковин. Девочка была зачарована тем, как во время окрашивания проявляются невидимые в нативных организмах структуры и можно увидеть белки, взаимодействующие с ионами кальция. Выбор был сделан — химия в приложении к биологии. Дженнифер, опираясь на свой опыт и навыки, за короткое время сделала ряд добротных классических работ по структуре фермента Cas9, родственных ферментов из других бактерий, комплексов белок — ДНК и белок — РНК. Эти результаты стали доступны научной общественности в 2009–2011 годах. В этот же период и произошла встреча с Эмманюэль Шарпантье, вылившаяся в совместную работу, появившуюся в журнале Science в 2012 году. Впервые in vitro была смоделирована система внесения направленных замен в ДНК и показано, какие компоненты надмолекулярного комплекса играют решающую роль в точности и эффективности манипуляций с ДНК. Простая по своей идее и изящная работа, имевшая изначально своей целью понять, как работает многокомпонентная молекулярная машина. Выполнена она 50 на 50% сотрудниками групп Дженнифер и Эмманюэль в Беркли, Вене и Умеа (Щвеция). Благодаря этим исследованиям стало очевидно, что в руках у человечества появился программируемый инструмент для вмешательства в геном. Две девушки не растерялись и анонсировали этот метод в статье в Nature 6 марта 2013 года под многозначительным названием «Биотехнология: переписывание генома».
Однако 36 днями раньше, 29 января, вышло сразу четыре статьи в Nature с демонстрацией направленного редактирования генома уже не in vitro, а на культуре клеток млекопитающих, бактериях и эмбрионах рыбок. Еще две статьи были опубликованы 15 февраля в журнале Science. Между собой состязались коллективы из Гарварда, Рокфеллеровского и Сеульского университетов. Счет времени шел не просто на дни, а на часы. Наверное, каждый из ученых, понимая значение своей работы, мечтал о заветной медали. Можно только догадываться, какое невероятное напряжение и стахановские темпы сделали возможным появление на свет этих результатов.
За истекшие семь лет технология геномного редактирования необратимо стала частью инструментария современной биологической науки. В нашей стране ее используют для исследовательских целей в ведущих институтах и научных центрах. Она дает возможность, проводя адресные замены в геноме культивируемых клеток и у экспериментальных животных, понять функции жизненно важных генов, в том числе ответственных за наследственные заболевания. В ФИЦ «Пущинский научный центр биологических исследований Российской академии наук» в рамках Национального проекта «Наука» создана лаборатория геномного редактирования и трансгенеза, специализирующаяся на направленной модификации генов рецепторных белков. Пока первые результаты получены на культурах клеток, но исследователи мечтают получить трансгенных экспериментальных животных, которые до недавнего времени закупались только за рубежом. Бесспорно, технология CRISPR-Cas — инструмент, но именно появление новых методов обеспечивает качественный скачок в развитии науки. После 2013 года Дженнифер Дудна и Эмманюэль Шарпантье продолжили заниматься структурой и физико-химическими механизмами, лежащими в основе работы CRISPR-Cas. Были открыты и исследованы схожие системы из различных микроорганизмов, прояснены детали работы ДНК-РНК-белковых комплексов на уровне внутримолекулярных событий, охарактеризованы регуляторы, блокирующие работу редактирующей машины. Вполне естественно, что осознание беспрецедентных возможностей для вмешательства в святая святых живого организма, в его геном, которые привносит новый метод, спровоцировало широкое обсуждение связанных с его применением этических проблем в самых разных слоях общества. Будущие нобелевские лауреаты не остались в стороне от этого обсуждения, выступая с программными статьями, призывающими не переоценивать возможности новой технологии и с осторожностью экстраполировать ее на применение в медицине, в особенности для манипуляций с репродуктивными клетками и эмбрионами.
А что же с одним из первооткрывателей системы CRISPR-Cas, получившим экспериментальное подтверждение ее функциональности, Рудольфом Баррангоу? Он теперь профессор в Университете Северной Каролины, занимается пищевыми технологиями и поиском новых пробиотиков, основатель и главный редактор журнала CRISPR Journal, ставшего трибуной для продвижения в том числе и его собственных идей о перспективах этой технологии. Баррангоу остается фанатом CRISPR, микробиологом-экспериментатором, мечтающим с помощью геномного редактирования накормить человечество, а в будущем — излечить от моногенных наследственных заболеваний. На его машине вместо номера крупными буквами написано ”CRISPR”.
Перед Нобелевским комитетом стояла сложна задача. Ведь на пьедестале почета должны стоять в том числе и авторы вполне законченной теоретической концепции о роли CRISPR и первой доказательной работы — наш соотечественник Евгений Кунин и француз Рудольф Баррангоу. Далее экспериментаторы, вскрывшие внутреннюю механику работы молекулярной машины. И наконец целая команда ученых из Гарварда, Рокфеллеровского университета и из Сеула, воплотивших эти знания в жизнь и получивших первые организмы с отредактированным геномом. Комитет принял свое решение, возможно, по принципу симметрии…Так или иначе, присуждение премий в области науки несравнимо прозрачнее, нежели в случае премии по литературе и Нобелевской премии мира. Что бесспорно, так это то, что все участники этой истории — люди, для которых наука стала образом жизни, они способны прилагать колоссальные усилия при достижении цели, ловить на лету и воспринимать новые идеи. В этом отношении судьба Нобелевской премии по химии 2020 года являет нам неплохой урок, заставляющий задуматься о том, какие пока еще не осмысленные открытия варятся в котле сегодняшней физико-химической биологии, как не пропустить то самое жемчужное зерно. У российских ученых наравне с другими всё еще остается шанс занять верхнюю ступеньку пьедестала…
Ирина Масулис,
канд. биол. наук, Институт биофизики клетки РАН ФИЦ
«Пущинский научный центр биологических исследований Российской академии наук»
Jansen R., Embden J. D., Gaastra W., Schouls L. M. Identification of genes that are associated with DNA repeats in prokaryotes. Mol Microbiol. 2002 Mar; 43(6): 1565-75. doi: 10.1046/j.1365-2958.2002.02839.x.
Makarova K. S., Grishin N. V., Shabalina S. A., Wolf Y. I., Koonin E. V. A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biol Direct. 2006 Mar 16; 1:7. doi: 10.1186/1745-6150-1-7.
Barrangou R., Fremaux C., Deveau H., Richards M., Boyaval P., Moineau S., Romero D. A., Horvath P. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 2007 Mar 23; 315(5819): 1709-12. doi: 10.1126/science.1138140.
Wiedenheft B., Zhou K., Jinek M., Coyle S. M., Ma W., Doudna J. A. Structural basis for DNase activity of a conserved protein implicated in CRISPR-mediated genome defense. Structure. 2009 Jun 10; 17(6): 904-12. doi: 10.1016/j.str.2009.03.019.
Semenova E., Nagornykh M., Pyatnitskiy M., Artamonova I. I., Severinov K. Analysis of CRISPR system function in plant pathogen Xanthomonas oryzae. FEMS Microbiol Lett. 2009 Jul; 296(1): 110-6. doi: 10.1111/j.1574-6968.2009.01626.x.
Pougach K., Semenova E., Bogdanova E., Datsenko K. A., Djordjevic M., Wanner B. L., Severinov K. Transcription, processing and function of CRISPR cassettes in Escherichia coli. Mol Microbiol. 2010 Sep; 77(6): 1367-79. doi: 10.1111/j.1365-2958.2010.07265.x.
Haurwitz R. E., Jinek M., Wiedenheft B., Zhou K., Doudna J. A. Sequence- and structure-specific RNA processing by a CRISPR endonuclease. Science. 2010 Sep 10; 329(5997): 1355-8. doi: 10.1126/science.1192272. PMID: 20829488 Free PMC article.
Sashital D. G., Jinek M., Doudna J. A. An RNA-induced conformational change required for CRISPR RNA cleavage by the endoribonuclease Cse3. Nat Struct Mol Biol. 2011 Jun; 18(6): 680-7. doi: 10.1038/nsmb.2043. Epub 2011 May 15.
Jinek M., Chylinski K., Fonfara I., Hauer M., Doudna J. A., Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17; 337(6096): 816-21. doi: 10.1126/science.1225829. Epub 2012 Jun 28.
Charpentier E., Doudna J. A. Biotechnology: Rewriting a genome. Nature. 2013 Mar 7; 495(7439): 50-1. doi: 10.1038/495050a.
Doudna J. A., Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014 Nov 28; 346(6213): 1258096. doi: 10.1126/science.1258096.
Doudna J. Perspective: Embryo editing needs scrutiny. Nature. 2015 Dec 3; 528(7580): S6. doi: 10.1038/528S6a.
Barrangou R., Doudna J. A. Applications of CRISPR technologies in research and beyond. Nat Biotechnol. 2016; 34(9): 933-941. doi: 10.1038/nbt.3659. Epub 2016 Sep 8.
Doudna J. CRISPR’s unwanted anniversary. Science. 2019 Nov 15; 366(6467): 777. doi: 10.1126/science.aba1751.
Doudna J. A. The promise and challenge of therapeutic genome editing. Nature. 2020 Feb; 578(7794): 229-236. doi: 10.1038/s41586-020-1978-5. Epub 2020 Feb 12.

 (3 оценок, среднее: 4,33 из 5)
(3 оценок, среднее: 4,33 из 5)
Вот это как-нибудь прокомментируйте, пожалуйста
https://en.wikipedia.org/wiki/Virginijus_%C5%A0ik%C5%A1nys
Да, действительно, и идейно и методически работа ученых из Вильнюсского университета Виргиниуса Шикшниса и Гедриуса Газиунаса из PNAS (Proc Natl Acad Sci U S A. 2012 Sep 25;109(39)) очень похожа на работу нобелевских лауреатов, опубликованную в Science, даже электрофорезные картинки об одном и том же. В абстракте сказаны все нужные слова о возможности программируемого вмешательства в геном. Это, бесспорно, делает им честь. Правда, в Science еще приведены данные о роли tracrRNA. Конечно, стоило про это написать. Статья в Science подана 8 июня 2012 г., появилась on-line 28 июня, а в PNAS подана в феврале 2011, опубликована 4 сентября 2012 г. Предвзятое отношение исключить нельзя, хотя и доказательств этому нет… Литовские ученые, прекрасно понимая возможное прикладное значение своих результатов, подали заявку международный патент с приоритетом от 20 марта 2012 г. «Rna-directed Dna Cleavage By The Cas9-crrna Complex» WO 2013/141680 A1 . Это вроде бы опережает по дате приоритета патент лауреатов «Methods And Compositions For Rna-directed Target Dna Modification And For Rna-directed Modulation Of Transcription» — 25 мая 2012 г. Но был еще один патент с участием Дудна «Modified cascade ribonucleoproteins and uses thereof», поданный от созданной ими же компании CARIBOU BIOSCIENCES INC [US] (типа как у нас сейчас модно МИПа) с датой приоритета 30 декабря 2011 г. Может, это и стало решающим… В целом, хотелось написать про то, как изменился подход к оценке нобелевских открытий. Сейчас, возможно, Колумбу не дали бы премию за открытие Америки, он не выполнил задание королевского дома , а всего лишь обнаружил неописанный ранее участок земли. А Кортес, наоборот, освоил эту землю и обеспечил экономическое процветание метрополии. Кортес тоже не так уж страшен, его технология колонизации была не самой бесчеловечной, по крайней мере, в Мексике памятники Кортесу не ликвидировали, стоят гордо по всей стране. Но, похоже, в науке настало время Кортесов, хотя ими тоже стать непросто.
Большое спасибо за развернутый ответ! Интересно. Казалось бы, коль скоро
литовцы подали свою статью раньше, то, мне, по крайней мере, совершенно
очевидно, что премию надо присуждать им! Что касается деталей, то, разумеется, в разных статьях они разные и всегда можно найти формулировку, выгодно отличающую одну статью от другой, при желании. По-моему, в данном случае надо искать доказательство непредвзятого отношения. Ну, собственно, решения Нобелевского комитета зачастую вызывают удивление, особенно
в последнее время. По-моему, это приводит к тому, что престиж премии падает
прямо на глазах. Собственно, я соавтор статьи про черные дыры в этом же
номере. Там ситуация такая — Пенроуз — личность исключительная, как и
недавно скончавшийся Стивен Хокинг. По-моему, это уже даже и не важно,
есть у такого человека Нобель или нет, равно как у Льва Толстого. Один из
других людей — весьма заслуженный наблюдатель, присуждение Нобеля ему
не удивляет, хотя, надо понимать, что там работали большие группы, да
и объект, в некотором смысле, не уникальный, да и говорили про него многие
и разное на протяжении большого количества времени, поэтому сложно
сказать, кто на самом деле заслужил премии. Про третьего лауреата я
услышал из объявления о присуждении, хотя, возможно, это связано с
тем, что наши области не пересекаются..
Не будучи молекулярным биологом, хотел бы обозначить некоторые ключевые точки 1) Да, действительно, и идейно и методически работа ученых из Вильнюсского университета Виргиниуса Шикшниса и Гедриуса Газиунаса из PNAS (Proc Natl Acad Sci U S A. 2012 Sep 25;109(39)) очень похожа на работу нобелевских лауреатов, опубликованную в Science… 2) Статья в Science подана 8 июня 2012 г., появилась on-line 28 июня, 3) в PNAS подана в феврале 2011, опубликована 4 сентября 2012 4) Литовские ученые… подали заявку международный патент с приоритетом от 20 марта 2012 г…. «Это вроде бы опережает по дате приоритета патент лауреатов… от 25 мая 2012 г. Но был еще один патент с участием Дудна « с датой приоритета 30 декабря 2011 г.. Мои вопросы по ключевым точкам следующие: Вопрос 1: является ли статья литовских исследователей первым описанием именно метода CRISPR в том виде, в котором он известен сейчас, т.е если бы мы могли повторить их статью в 2011 году — то это был и был бы то же метод CRISPR, описанный в статье лауреатов в Science? Вопрос 2: если литовские исследователи знали, что они открыли эту технологию раньше всех, пытались ли они каким либо образом отстоять приоритет (вопрос риторический конечно, ибо лучше всего спросить у них самих, но вдруг уже есть ответ)? Вопрос 3. Дата отправки литовской статьи в журнал PNAS фиксируется на сайте журнала, как и PDF -файл препринта статьи, которому обычно должен присваиваться уникальный номер. Если в Science появилась публикация на схожую тему в июне, то имело ли смысл отправить редакции science предпринт литовской статьи с теми же данными о CRISPR от февраля 2011 года с уникальным идентификационным номером для отстаивания приоритета? Вопрос 4: если бы литовский предпринт был опубликован на biorxiv в феврале 2011 года, хватило бы этого для безоговорочного установления приоритета литовских ученых? Вопрос 5: Если речь идет о только что открытом природном явлении (явлении… Подробнее »
PS. Статья Шишкинса была подана в PNAS 21 мая 2012 года, а до этого в апреле 2012 была отвергнута журналом Cell https://www.forbes.ru/forbeslife/411635-tihie-voyny-bolshoy-nauki-kak-uchenye-i-universitety-boryutsya-za-velikie
Вопрос — а откуда взялась дата — февраль 2011 года?
21 мая отправлена на рецензию, когда поступила — попробую восстановить…. Самой странно, что дата поступления в редакцию на данном pdf не отражается, как это обычно бывает.
«Самой странно, что дата поступления в редакцию на данном pdf не отражается, как это обычно бывает» — в любом случае если верить Forbes, то в PNAS статья никак не могла быть подана раньше чем в cell, а это 6 апреля 2012. А патент от Дудна был подан 30 декабря 2011 года…
Неужели вы думаете, что выбирая между литовскими и американскими учеными, Нобелевский комитет отдаст премию литовцам! Вы просто, как дети малые. Представьте себе, сколько обращений в поддержку американцев поступило в Нобелевский комитет! В том числе, от американских Нобелиатов, которых великое множество. В русском языке есть хорошее выражение, которое объясняет эту ситуацию: «Взять нахрапом».
«Неужели вы думаете, что выбирая между литовскими и американскими учеными, Нобелевский комитет отдаст премию литовцам!» — разумеется не думаю, ведь известно кто основной спонсор комитета. Другое дело что мне любопытно как бы повел себя журнал science и комитет в случае если бы литовский предпринт действительно был бы опубликован открыто в феврале 2011 году, какие были бы формулировки с их стороны, или они бы обошлись молчанием? В конце концов случай с Перельманом и его опубликованными в архиве предпринтами как то нельзя исключать, а положение Перельмана было гораздо хуже чем у литовских исследователей, которые имели официальную публикацию (в отличии от Перельмана).
Такая история отнюдь не нова, Свердлов в 1970-ых первым открыл и опубликовал новый метод секвенирования, причем в англоязычном журнале, а Нобелевскую премию за это получили совсем другие люди с публикацией в Nature. Никто впрочем насколько мне известно открыто не возмущался. Или случай с Виктором Охониным и его советским патентом от 1986 года на новый тип микроскопа, за который дали премию в 2014 и который был разработан на западе не ранее 1994 года. То же все хранят каменное молчание.
Во всей этой ситуации я вижу только одно — полное отсутствие ясных механизмов отстаивания приоритета в научной среде, и даже более ранняя публикация не является доказательством. Хотя в случае с Литовскими исследователями судя по всем не такой уж ранней она и была, патент Дудны был все же чуть раньше.
PS. “Неужели вы думаете, что выбирая между литовскими и американскими учеными, Нобелевский комитет отдаст премию литовцам” — на самом деля я думаю, что проблема была еще и в том, что попыток отстоять приоритет во многих случаях просто не было, и никто не знает как бы повернулось, если бы такие попытки были. Ведь если публикация более ранняя, то этот факт неопровержим при любом раскладе. И заниматься отстаиванием приоритета надо сразу, а не после бала (нобеля).
Статья в Cell, где можно найти дополнительную информацию об истории исследования системы CRISPR: https://www.cell.com/cell/fulltext/S0092-8674(15)01705-5
PS. Дискуссия закончилась толком не начавшись, оборвавшись на установлении точной даты подачи литовского предпринта. Что уж тут тогда говорить о дальнейшем отстаивании приоритета…